E’ estate, una calda estate. E allora fa
sempre piacere uscire a prendere un po’ d’aria e può capitare di chiedersi perché
quest’aria ha una certa composizione e così tanto Azoto.
Oppure, in una di queste giornate dove
il tasso di umidità è al limite della sopportazione, di pensare a quale sia la
percentuale di vapore acqueo e quanta acqua può venir “prodotta” da un
condizionatore.
Nel post 93. Clorofilla ed Emoglobina si sono prese in considerazione le
abbondanze degli elementi chimici nell’Universo,
nella crosta terrestre, nell’acqua di mare e nel corpo umano.
La crosta
terrestre è l’unica dove l’Ossigeno
è al primo posto (47%) e il Silicio
al secondo (28%); negli altri casi è sempre l’Idrogeno il più abbondante e il Silicio si trova solo nella crosta
terrestre.
Dell’Azoto si ha qualche traccia significativa solo nel corpo umano.
Se ora
prendiamo in considerazione l’atmosfera terrestre abbiamo una situazione ancora una volta completamente
differente:
l’aria è composta dal 78,1% di Azoto, dal 20,9% di Ossigeno, dallo 0,95% di Argon ed in percentuali sempre
inferiori:
Anidride
Carbonica, Neon, Elio, Metano, Krypton, Idrogeno, ecc.

Leonardo
da Vinci definiva l’atmosfera una specie di fluido
pesante, compressibile e resistente, che avvolge la sfera della terra e
dell'acqua; il peso e la pressione che essa esercita su tutti i corpi alla
superficie della Terra furono riconosciuti da Galileo Galilei.
Il vapore
acqueo nell'aria è di solito meno dell'1% in volume, ma può raggiungere il
4% nei climi umidi; è ovvio che la quantità di vapor d'acqua saturo presente
nell'aria dipende dalla temperatura.
Attenzione: quando parliamo di vapore acqueo, non stiamo prendendo in considerazione
le nuvole… In meteorologia una
nuvola è costituita da minute particelle d'acqua condensata e/o cristalli di
ghiaccio, sospese per galleggiamento nell'atmosfera e solitamente non a
contatto con il suolo.
Nell'antichità erano conosciuti solo
pochi elementi: Carbonio, Oro, Argento, Rame,
Zolfo, Stagno, Piombo, Mercurio, Antimonio e Ferro; mentre Arsenico e Zinco
erano note prima del XV secolo; infine, all’epoca della rivoluzione francese erano conosciuti (in ordine di scoperta):
Fosforo 1669
Cobalto 1737
Platino 1748
Nichel 1751
Bismuto 1753
Idrogeno 1766
Azoto 1772
Cloro 1774
Manganese 1774
Ossigeno 1774
Molibdeno 1782
Tellurio 1783
Tungsteno 1783
 |
| Elementi chimici noti nel 1790 |
Il rame
è forse il più antico metallo conosciuto, così importante da dare il nome ad un
periodo durato diversi millenni: l’età
del rame.
L'età
del bronzo indica invece il periodo successivo caratterizzato dall'utilizzo
sistematico ed esteso della metallurgia del bronzo che, per quanto riguarda
l'Europa, si estende dal 3500 a.C. al 1200 a.C. circa.
Il termine bronzo identifica la lega
rame/stagno.
Tornando ad Azoto e Ossigeno, questi
furono identificati all’incirca nello stesso periodo 1772 e 1774.
Daniel
Rutherford chiamò l’Azoto
“aria nociva”, mentre altri lo soprannominarono “aria bruciata”. Antoine Lavoisier (padre della chimica
moderna) gli diede il nome di Azoto
(dal greco azotos, senza vita).
Il nome inglese Nitrogen significa “formante nitro”
e deriva dal fatto che il nitrato di
potassio (sale di potassio dell'acido
nitrico, comunemente noto anche con il nome di salnitro o nitro) è un minerale comune che
contiene Azoto.
La risposta al perché l’Azoto sia l’elemento principale dell’aria con 4 parti su 5 si può
trovare nelle seguenti argomentazioni:
o è
un gas volatile
o
e’ inerte con i materiali che compongono
la crosta terrestre
o e’
molto stabile in presenza di radiazione solare
Nella composizione dell’Universo, Ossigeno e Azoto hanno all’incirca la stessa percentuale (anche se insieme arrivano
solo all’1%), ma l’Ossigeno è
sicuramente meno inerte dell’Azoto
(come riportato sopra, dove si può notare quanto Ossigeno ci sia nella crosta
terrestre).
L’Azoto
è un gas inerte, in condizioni opportune ha la fondamentale funzione di
fertilizzare il suolo, ed è indispensabile ai vegetali quanto la vitamina C lo è
per noi. Raramente reagisce con altre sostanze e la difficoltà di farlo
partecipare a reazioni importanti lo rese una delle sostanze più studiate da
diverse generazioni di chimici.
Per "catturare" l’Azoto si procede in questo modo:
o si porta il gas ad alte temperature
o lo si mette a contatto con l’idrogeno
o si aumenta la pressione a centinaia di atmosfere
o si aggiunge l’Osmio che funge da catalizzatore
Questa sostanza viene utilizzata per molti scopi ed è alla base di tutti i
fertilizzanti.
L’Azoto liquefa
a 77,35 K (−195,82 °C) e solidifica a 63,14
K (−210,03 °C).
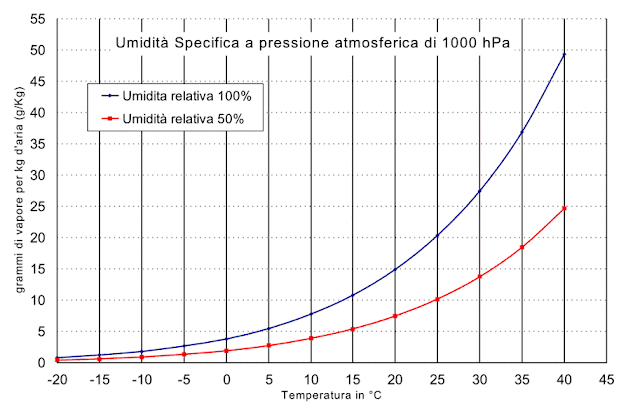
Se liquefassimo l’aria di un
appartamento medio, otterremmo circa 400 litri di Azoto liquido, mentre l’acqua raccolta dipende dalla percentuale
dell’umidità e dalla temperatura:
Con una temperatura che supera i 30
gradi e percentuali di umidità dell’ordine dell’80%, si potrebbero avere tra i
5 e i 10 litri d’acqua (senza considerare l’apporto dato da esseri umani e
animali presenti).
https://en.wikipedia.org/wiki/Timeline_of_chemical_element_discoveries
Malgrado la
sua particolare attitudine di gas inerte, l’Azoto è presente in molte sostanze. In natura come nitrato di Potassio KNO3
(salnitro) e nitrato di Sodio NaNO3 (nitro del
Cile). E’ un costituente di proteine
e acidi nucleici.
I più importanti
ossidi di Azoto sono il monossido NO
e il diossido NO2.
Non è
possibile elencare tutte le sostanze in cui è presente l’Azoto e mi limiterò ad alcune delle più note:
Cianuro CN-
Nicotina C10H14N2
Nitroglicerina C3H5(ONO2)3
Inoltre: Caffeina,
Morfina, Serotonina, Adrenalina, Idrazina, ecc.
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1918/
http://zibalsc.blogspot.it/2014/06/153-acqua-ed-aria.html

Nessun commento:
Posta un commento